Freiburger Physiologen entschlüsseln Nierenfunktion und Prozesse der Sinneswahrnehmung
Freiburg, 23.01.2023
Physiologen beschäftigen sich mit den Funktionen und Abläufen im menschlichen, tierischen oder pflanzlichen Organismus. An der Medizinischen Fakultät der Universität Freiburg erforschen Wissenschaftler*innen unter anderem die Filterfunktion der menschlichen Niere und analysieren den molekularen Aufbau und Aktivierungsmechanismus der Transient Rezeptor Potential Kanäle im Nervensystem, welche die Sinneswahrnehmung verarbeiten.
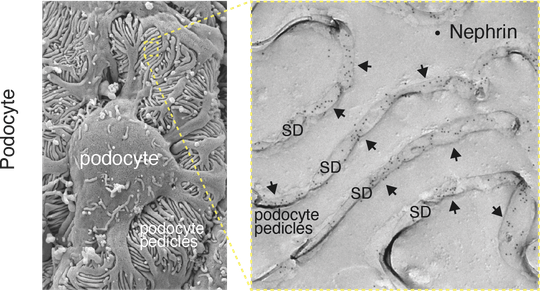 Links: EM-Scanbild der Podozyten, die mit ihren Fußfortsätzen (Pedikeln) Blutgefäße umschließen, Rechts: EM-Bild eines Gefrierbruchs, das die Pedikel und das dazwischen liegende "Schlitzdiaphragma" (SD) zeigt. Die Nephrin-Proteine des SD sind mit Antikörpern angefärbt, die Goldpartikel tragen (Punkte in schwarz).
Links: EM-Scanbild der Podozyten, die mit ihren Fußfortsätzen (Pedikeln) Blutgefäße umschließen, Rechts: EM-Bild eines Gefrierbruchs, das die Pedikel und das dazwischen liegende "Schlitzdiaphragma" (SD) zeigt. Die Nephrin-Proteine des SD sind mit Antikörpern angefärbt, die Goldpartikel tragen (Punkte in schwarz).
Schlitzmembran in der Niere: ein sensorisches Netzwerk – kein Filter
Für das Leben von Säugetieren ist die Filtration ihres Blutes von grundlegender Bedeutung, da so Stoffwechselendprodukte und Giftstoffe effektiv aus dem Blut entfernt und überschüssige Wasser- und Elektrolytmengen schnell ausgeschieden werden. Die Filtration findet in den Nieren statt und muss sich ständig an den Lebensstil und die Ernährung des Säugetieres anpassen. Bei diesem lebenswichtigen Prozess bildet die Schlitzmembran ein Schlüsselelement als die letzte von drei Komponenten des Nierenfilters. Bislang jedoch konnte aus technischen Gründen nicht geklärt, aus welchen Proteinen sich die Membran zusammensetzt und wie sie die Filtration reguliert. Ein Team um die Freiburger Forscher Prof. Dr. Bernd Fakler sowie Dr. Maciej Kocylowski vom Institut für Physiologie und Dr. Florian Grahammer vom Universitätsklinikum Hamburg-Eppendorf hat nun die Proteinbausteine der Schlitzmembran einer Maus identifiziert und seine Funktion genauer definiert.
Mithilfe einer hochauflösenden Proteomanalyse und quantitativer Massenspektrometrie konnten die Forschenden zeigen, dass die Schlitzmembran aus den Komponenten Nephrin, Neph1 und Podocin sowie einem bisher unbekannten hochmolekularen Proteinnetzwerk aufgebaut ist. „Dieses Netzwerk hat eine doppelte Funktion", sagt Kocylowski. „Es dient als Anker für die schlitzüberspannenden Proteine Nephrin und Neph1 und verbindet gleichzeitig den schlitzbildenden Teil der Membran mit dem Zytoskelett der zugehörigen Zelle (Podozyt) und den Signalwegen, die in ihnen ablaufen.“
Schlitzmembran fungiert als sensorisches System bei der Blutfiltration
Mit ihren Ergebnissen aus proteomischen und funktionellen Analysen wiesen die Wissenschaftler*innen außerdem nach, dass die Schlitzmembran nicht als passiver Filter, sondern als komplexes sensorisches System für die dynamische Regulation der Blutfiltration in der Niere fungiert. Die Bedeutung des Netzwerks wurde deutlich, als Grahammer und sein Forschungsteam einzelne Bestandteile des neu identifizierten Netzwerks entfernten und feststellten, dass die Filtration dadurch beeinträchtigt oder sogar vollständig verhindert wird.
„Dieses System verleiht der Nierenfiltration wahrscheinlich eine kontextabhängige Dynamik, die für die Anpassung des Filters an die Anforderungen der sich ständig ändernden Bedingungen notwendig ist“, erklärt Fakler. Im Anschluss an diese Arbeit planen die Forschenden nun, die neu identifizierten Schlitzmembran-Komponenten zu untersuchen, um zu verstehen, wie genau sie die Nierenfiltration regulieren und welche Rolle sie bei der Verschlechterung der Nierenfunktionen (Niereninusffizienz) und dem dadurch bedingten lebensbedrohlichen Proteinverlusts spielen könnten.
Verarbeitung von Sinneseindrücken verstehen lernen
Bei der Verarbeitung von alltäglichen Sinneseindrücken wie Geschmack, Sehen, Schmerz oder Wärme sind sogenannte Transient Rezeptor Potential Kanäle (TRP Kanäle) beteiligt. Sie sitzen unter anderem in den Zellen des Nervensystems. Für ihre Entdeckung und Erforschung wurden David Julius und Ardem Patapoutian 2021 mit dem Nobelpreis für Medizin ausgezeichnet. Freiburger Wissenschaftlern rund um Bernd Fakler und Dr. Astrid Kollewe sowie Kolleg*innen der Universität des Saarlands ist es nun gelungen, den molekularen Aufbau von TRPC Kanälen im Gehirn von Mäusen sowie ihren Aktivierungsmechanismus zu entschlüsseln. TRPC Kanäle sind die sogenannte „klassische Unterfamilie“ der TRP Kanäle. Sie spielen eine wichtige Rolle bei der Informationsweitergabe zwischen Nervenzellen. Defekte TRPC Kanäle können zu Bewegungsstörungen oder Nierenerkrankungen führen.
TRPC Kanäle sind in größere Proteinkomplexe eingebunden
Mittels hochauflösender Proteomanalyse-Techniken konnte das Forschungsteam die Zusammensetzung der TRPC Kanäle nun im Gehirn von Mäusen entschlüsseln. „Unsere Experimente haben gezeigt, dass TRPC Kanäle im Gehirn nicht als isolierte Kanalporen vorliegen, sondern in größere Komplexe mit weiteren Proteinen eingebunden sein müssen“, erklärt Kollewe. „Zusätzlich haben wir gesehen, dass beim Zusammenbau der TRPC Proteine zu Kanalporen nicht alle Kombinationsmöglichkeiten, die experimentell möglich sind, auch genutzt werden, und dass verschiedene TRPC Unterklassen sehr unterschiedliche Präferenzen zur Bildung gemischter oder einheitlicher Kanalporen haben.“ Darüber hinaus identifizierten die Wissenschaftler*innen weitere 15 Proteine, die im Maushirn mit Unterklassen der TRPC Kanälen wechselwirken. „Die meisten dieser Proteine waren vorher noch gar nicht mit TRPC Kanälen in Verbindung gebracht worden“, sagt Fakler.
Über den Aktivierungsmechanismus der TRPC Kanäle konnten die Forschenden daraufhin zeigen: Ca2+ (Kalziumionen (Ca2+)) muss in direkter Nachbarschaft zum TRPC Kanal ausgeschüttet werden, um diesen zu stimulieren. „Auch, wenn die Aktivierung theoretisch ohne eine direkte Interaktion zwischen dem Ca2+-freisetzenden Rezeptor und dem TRPC Kanal stattfinden könnte, dient die von der Natur gewählte Komplexbildung zwischen beiden wohl dazu, die Signalweiterleitung zuverlässiger zu machen“, erläutert Fakler. „Zusätzlich wird die Aktivierung räumlich begrenzt und die Signalweitergabe beschleunigt.“
Faktenübersicht
- Originalpublikationen:
- Kocylowski MK, Aypek H, Bildl W, Helmstädter M, Trachte P, Dumoulin B, Wittösch S, Kühne L, Aukschun U, Teetzen C, Kretz O, Gaal B, Kulik A, Antignac C, Mollet G, Köttgen A, Göcmen B, Schwenk J, Schulte U, Huber TB, Fakler B, Grahammer F. A (2022): A Slit-diaphragm-associated protein network for dynamic control of renal filtration. In: Nature Communications. DOI: https://doi.org/10.1038/s41467-022-33748-1
- Kollewe A, Schwarz Y, Oleinikov K, Raza A, Haupt A, Wartenberg P, Wyatt A, Boehm U, Ectors F, Bildl W, Zolles G, Schulte U, Bruns D, Flockerzi V, Fakler B (2022). Subunit composition, molecular environment, and activation of native TRPC channels encoded by their interactomes. In: Neuron. DOI: https://doi.org/10.1016/j.neuron.2022.09.029
- Fakler leitet seit 2001 die Abteilung II des Physiologischen Instituts an der Medizinischen Fakultät der Universität Freiburg
- Fakler forscht insbesondere zur molekularen Organisation und Funktion der schnellen Signalübertragung an der Zellmembran, zur Proteom-Analyse von Membranproteinen und zu der Struktur-Funktionsanalyse von Ionenkanälen und G-Protein-gekoppelten Rezeptoren
- Fakler ist Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies und bei BIOSS – Centre for Biological Signalling Studies
- Fakler war Sprecher des erfolgreich abgeschlossenen Sonderforschungsbereichs SFB 746, der sich mit der funktionellen Spezifität durch Kopplung und Modifikation von Proteinen beschäftigte.

