Künstlerische Bakterienkulturen
Freiburg, 16.09.2022
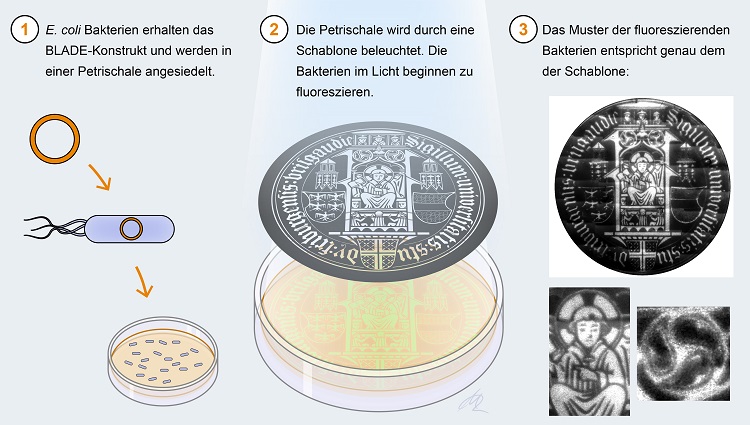
Zum gemeinsamen Jahrestag schenkte der Biologe Edoardo Romano seiner Freundin etwas Selbstgemachtes: einen schwarz-weißen Schnappschuss des Paares, der nur auf den ersten Blick nach einem klassischen Erinnerungsstück aussieht. Tatsächlich ist das Foto ein kleines biologisches Kunstwerk, in dem die Arbeit von Millionen Mikroorganismen steckt. Es zeigt eine Bakterienschicht in einer Petrischale, die das Paar dank fluoreszierender Proteine abbildet. Durch eine Maske des Erinnerungsfotos belichtet, aktivieren die Bakterien in den hellen Bereichen des Bildes Moleküle, die unter einem Fluoreszenzmikroskop grün erscheinen – davon schoss Romano ein Foto und druckte es aus. „Dieses synthetische Protein ist unser neustes optogenetisches Werkzeug: Wir haben es BLADE genannt“, erklärt Prof. Dr. Barbara Di Ventura, Professorin für biologische Signalforschung an der Universität Freiburg, bei der Romano promoviert.
 Ein besonderes Fotogeschenk dank eines neuen optogenetischen Werkzeugs: Es ist kein klassischer Schnappschuss, sondern eine Bakterienschicht in einer Petrischale, die das Paar dank fluoreszierender Proteine abbildet. Foto: Edoardo Romano
Ein besonderes Fotogeschenk dank eines neuen optogenetischen Werkzeugs: Es ist kein klassischer Schnappschuss, sondern eine Bakterienschicht in einer Petrischale, die das Paar dank fluoreszierender Proteine abbildet. Foto: Edoardo Romano
Di Venturas Forschungsbereich ist die synthetische Biologie. Sie ist Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg und hat eine der Kernprofessuren am BIOSS – Centre for Biological Signalling Studies inne. Vor Kurzem publizierte ihre Arbeitsgruppe im Fachmagazin „Nature Chemical Biology“ eine Studie über das BLADE-System. Eine der Abbildungen zeigt eine solche so genannte Bakteriografie. Nicht ohne Augenzwinkern bedienten sich die Forschenden in diesem Fall einer bekannten popkulturellen Referenz der Science-Fiction: Sie reproduzierten mit den Bakterienkulturen ein Poster des Filmklassikers „Blade Runner“ – so genau, als wäre es eine Fotokopie.
Potenzial der Optogenetik für die Signalforschung
Als Ingenieurin und Biologin im Feld der synthetischen Biologie gehört Di Ventura zu denen, die eher die Gegenwart überholen, als Science-Fiction zu produzieren: Sie arbeitet an Zukunftstechnologien, um besonders für die Grundlagenforschung Nützliches zu schaffen: „Im Feld der synthetischen Biologie herrscht ein großer Erfindergeist“, erklärt sie. „Zuerst kommen die Spielereien, wie dieses Bild, aber dahinter stecken spannende Tools, mit denen neue Entdeckungen in der Signalforschung erst möglich werden.“ Die Bakteriografie-Bilder zeigen, wie präzise die von Di Ventura zusammengestellten Molekülkomplexe reagieren: Signale, wie in diesem Fall Lichtstrahlen, aktivieren ein Molekül, das an DNA bindet und dort als so genannter Transkriptionsfaktor wirkt – das bedeutet, es steuert die Genexpression: Im Laufe dieses Prozesses liest die Zellmaschinerie Gene aus und wandelte sie in RNA sowie schließlich in Proteine um. „Die Genexpression ist der Grund dafür, dass alle Zellen eines Organismus zwar das gleiche Genom haben, aber ganz unterschiedliche Funktionen ausführen können“, beschreibt Di Ventura. Um die Bakteriografie zu erstellen, erhielten die Bakterienzellen von Romano im Labor ein Genstück, das ein fluoreszierendes Protein kodiert. Wird BLADE durch blaues Licht aktiviert, bindet ein Teil des eingeschleusten Molekülkonstrukts an die DNA, und der Transkriptionsfaktor erhöht die Produktion des grün fluoreszierenden Proteins. Das geschieht aber nur bei den Bakterienzellen in der Petrischale, die mit Licht bestrahlt werden. „Wir haben den Plastikdeckel der Schale mit einer Maske des Bildes beklebt – eine Art Schablone. Im Foto leuchten die lichtdurchlässigen Flächen nun grün. Die Auflösung ist einmalig“, berichtet Di Ventura.
Die neue Technik erlaubt der Forscherin zum Beispiel, die Funktionen einiger Gene in Kolibakterien besonders schnell zu ergründen. Man würde meinen, das Genom des Bakteriums Escherichia coli, das wohl in jedem molekularen Labor dieser Welt zu Hause ist, sei inzwischen vollständig entschlüsselt. Doch von etwa 35 Prozent der Gene ist die Funktion noch nicht erforscht. Fügen Biologinnen und Biologen statt fluoreszierender Proteine als Zielgen für das optogenetische Werkzeug ein anderes Gen ein, kann dessen Expression lichtgesteuert aktiviert werden. Die Forschenden erkennen, wie die Genprodukte auf die Zelle wirken – handelt es sich zum Beispiel um ein Verdauungsenzym für einen Zucker, regt es das Wachstum der Bakterien an. Die Optogenetik könnte aber auch am Menschen angewendet werden. „Für die Behandlung von Organen in der Nähe der Körperoberfläche, wie etwa dem Auge, lassen sich solche optogenetischen Techniken seit Neuestem zwar schon einsetzen, aber ihr Hauptnutzen ist noch immer klar die Grundlagenforschung“, sagt Di Ventura.
Die Dynamik von Proteinen ergründen
Die vielen verschiedenen Werkzeuge für die synthetische Biologie, die die Arbeitsgruppe entwickelt, werden weltweit zur Analyse biologischer Signale genutzt. Aber Di Ventura widmet sich auch persönlich der Erforschung von Transkriptionsfaktoren. Solche „Control-of-Function“-Anwendungen verwendet sie zum Beispiel im Rahmen des Exzellenzclusters CIBSS. „Wir wollen die Dynamik des Transkriptionsfaktors NF-kB mithilfe der Optogenetik verstehen“, erläutert sie. Dazu arbeitet sie unter anderem mit dem Arzt und Immunologen Prof. Dr. Bodo Grimbacher vom Universitätsklinikum Freiburg zusammen.
Der Begriff „Dynamik“ bezieht sich hier auf die Frage, wie sich die Produktion oder die Bewegung der Moleküle innerhalb von Zellen verändert: Werden sie zyklisch auf- und abgebaut? Verändert der Transport zwischen verschiedenen Teilbereichen der Zelle ihre Wirkung? NF-kB und weitere molekülvermittelte Signale in der Zelle sind für die Immunantwort und den programmierten Zelltod wichtig. NF-kB beispielsweise wird in den Zellkern transportiert und wieder hinaus. Dort beeinflussen diese Proteine die Genexpression: „Und hier können wir mit der Optogenetik an Zellkulturen herangehen und den Transkriptionsfaktor gezielt mit einem molekularen Schalter, der auf Licht reagiert, aus dem Kern heraus- und wieder hineinschleusen“, führt Di Ventura aus. „So verstehen wir, wie diese Signalkette im Detail die Zelle steuert. Es ist wichtig, diese Signalschritte genau zu verstehen – für die Immunologie und die Krebsforschung.“
 Grafik: Michal Rössler, Universität Freiburg.
Grafik: Michal Rössler, Universität Freiburg.
Schaltkreise aus Molekülen
Di Venturas Erfindungen und Forschungsergebnissen liegen meist so genannte biologische Schaltkreise und Oszillatoren zugrunde. Sie beschreiben Regelsysteme, zyklische Reaktionsketten und Vorgänge, die in der Zelle stattfinden, sich wiederholen und auf äußere Reize reagieren – wie bei einem Heizungsthermostat, der die Heizleistung an Außentemperatur und Innentemperatur anpasst, nur dass Di Venturas Systeme aus Proteinen, Rezeptoren und Genen bestehen. Über diese Schaltkreise beeinflussen Transkriptionsfaktoren die Zellaktivitäten und passen sie an die Umgebungsreize an.
„Das Reprogrammieren von einfachen Organismen wie Bakterien oder Hefen zum Nutzen der Menschen und für die Umwelt ist eine Möglichkeit der synthetischen Biologie“, beschreibt Di Ventura ihr Forschungsfeld. Damit können Forschende etwa alternative Energiequellen herstellen, Sensoren für Gefahrenstoffe entwickeln oder die Dekontamination der Umwelt ermöglichen. „Wir müssen natürlich sehr vorsichtig sein mit der Fähigkeit, Organismen zu schaffen, die neue Eigenschaften besitzen“, gibt Di Ventura zu bedenken. Für sie sind die ethischen Aspekte der synthetischen Biologie genauso wichtig wie die eigentliche biologische Forschung. „Aber in der Medizin könnten unsere Werkzeuge aus der synthetischen Biologie zum Beispiel zu präziseren Therapien bei Krebserkrankungen führen. Daran werden wir als Nächstes arbeiten,“ fügt sie hinzu. Sie möchte optogenetische Schaltkreise gezielt in Tumorzellen einschleusen, um die Zellen vor Ort zu zerstören, und zwar über körpereigene Signalwege, die den Selbstzerstörungsmechanismus der Zellen auslösen. „Hier sind wir noch ganz am Anfang. Wir wollen erst mal mithilfe der Optogenetik, also mit Licht als Auslöser, in Zellkulturen zeigen, dass das Prinzip Potenzial hat.“
Entwicklung neuer Krebstherapien
Um dieses Potenzial auszuloten und zu erforschen, erhielt Di Ventura 2020 einen mit zwei Millionen Euro dotierten Consolidator Grant des Europäischen Forschungsrats (ERC). „InCanTeSiMo – Intelligent Cancer Therapy with Synthetic Biology Methods“ heißt das Projekt. Gängige Chemotherapien gegen Krebserkrankungen wirken meist im ganzen Körper und nicht ausschließlich am Tumor und in den Krebszellen. Das bedeutet für die Patientinnen und Patienten oft, dass sie unter starken Nebenwirkungen leiden. Die gezielte Therapie von Krebs mit biologischen Schaltkreisen aus der synthetischen Biologie könnte hier hilfreich sein, ist aber bisher noch Zukunftsmusik.
Die große Herausforderung bei ihrem neuen Projekt besteht für Di Ventura darin, ein molekulares Vehikel zu entwickeln, das genau die richtigen Zellen beliefert und biologische Schaltkreise, die aus Netzwerken von synthetisch hergestellten Proteinen aufgebaut sind, dort einschleusen kann. Dann ließe sich die Therapie gezielt starten. „Licht wäre nur eine von vielen Möglichkeiten, die Schaltkreise anzuknipsen. Wir haben eine große Auswahl an molekularen Schaltern, die wir einbauen könnten“, erklärt die Forscherin. Hier kämen zum Beispiel auch bestimmte Medikamente infrage. Die Forschungsarbeiten dazu beginnen gerade, und somit wächst Di Venturas Team. Auch bei diesem Projekt ist Erfindergeist gefragt – diesmal aber mit dem Ziel einer konkreten medizinischen Umsetzung. „Denn das ist typisch für die synthetische Biologie: Was mit Spielereien in Escherichia-coli-Bakterien begann, mündet in reale technologische Anwendungen“, sagt die Forscherin. Und vielleicht sogar eines Tages in eine neue Form der Krebstherapie.
Prof. Dr. Barbara Di Ventura
hat Technische Informatik an der Universität La Sapienza in Rom/Italien studiert. 2007 wurde sie am European Molecular Biology Laboratory in Heidelberg im Bereich der synthetischen Biologie promoviert. Von 2007 bis 2011 war Di Ventura Postdoktorandin am Zentrum für Molekulare Biologie der Universität Heidelberg. Danach leitete sie die Arbeitsgruppe für synthetische Biologie am dortigen BioQuant-Zentrum. Seit 2017 ist sie Professorin für biologische Signalforschung an der Fakultät für Biologie der Universität Freiburg und bei BIOSS – Centre for Biological Signalling Studies. Dort leitet sie den Forschungsbereich C: Wiederaufbau und Biotechnologie. Seit 2019 ist sie zudem Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies. 2020 erhielt sie für das Forschungsprojekt InCanTeSiMo einen Consolidator Grant des Europäischen Forschungsrats (ERC).
Mathilde Bessert-Nettelbeck

