Bis das System kippt
Freiburg, 12.10.2020
Viel Fastfood und wenig Bewegung sind auf Dauer nicht gesund, das ist den allermeisten Menschen bekannt. Dass dieser Lebensstil, der in vielen Ländern üblich ist, aber auch das Immunsystem beeinflusst, wissen die wenigsten. Allergien, Asthma, Krebs – Krankheiten, die mit dem Immunsystem in Verbindung gebracht werden – sind auf dem Vormarsch. Die Freiburger Medizinerin Dr. Nina Chevalier will herausfinden, wie Ernährung und andere Umweltfaktoren immunologische Mechanismen anstoßen – und zwar so, dass das Immunsystem körpereigene Zellen attackiert. Vor allem auf zwei rheumatologische Autoimmunkrankheiten konzentriert sich die Ärztin und Wissenschaftlerin bei ihrer Forschung: die rheumatoide Arthritis und den systemischen Lupus erythematodes.
 Schmerzhafte Arthritis: Eine Freiburger Medizinerin will herausfinden, wie Ernährung und Umweltfaktoren immunologische Mechanismen anstoßen. Foto: Anut21ng Photo/stock.adobe.com
Schmerzhafte Arthritis: Eine Freiburger Medizinerin will herausfinden, wie Ernährung und Umweltfaktoren immunologische Mechanismen anstoßen. Foto: Anut21ng Photo/stock.adobe.com
Gelangen Pathogene wie Bakterien oder Viren in den Körper, mobilisiert das Immunsystem zunächst Fresszellen, die eine erste Schadensbegrenzung betreiben. Zeitgleich beginnt in den lymphatischen Organen wie den Lymphknoten die Vermehrung spezifischer Immunzellen, welche die umherschwirrenden Eindringlinge identifizieren und dann unschädlich machen. Das Problem ist, dass die Mobilmachung nicht immer rundläuft. Es können nämlich auch autoreaktive Zellen, die den eigenen Körper attackieren, aktiviert werden – unter anderem, weil körpereigene Strukturen und eingedrungene Pathogene einander sehr ähnlich sein können. Nina Chevalier nennt den Fehler im System „Toleranzbruch“. Körpereigene Strukturen zu tolerieren und von gefährlichen, körperfremden zu unterscheiden ist ein wesentliches Merkmal der spezifischen Immunantwort.
Autoreaktive Zellen machen nicht automatisch krank, da ein gesunder Körper auch sie unterdrücken kann. „Mitunter entsteht allerdings eine Autoimmunreaktion, die Krankheitswert hat“, führt Chevalier aus. Diese Reaktion könne durch das Zusammenspiel von Genen und Umwelteinflüssen ausgelöst werden. Ungesunde Ernährung, Stress, Umweltgifte, ein infektiöser Erreger: Solche Faktoren seien oft das Zünglein an der Waage, das das System zum Kippen bringt. Die Folge sind Entzündungen. Der Körper macht, was er immer macht, wenn ihn Keime oder andere Eindringlinge angreifen: Er läuft heiß, um sich zu wehren. Doch nicht mehr abklingende Entzündungen – die Auswirkungen eines fehlregulierten Immunsystems – schädigen das Gewebe. Autoimmunkrankheiten sind nicht heilbar, lassen sich aber behandeln, indem das überregulierte Immunsystem in der Breite gedämpft wird. Sollte die Wissenschaft die zugrunde liegenden Mechanismen auf molekularer Ebene entschlüsseln, ließe sich sehr viel zielgerichteter eingreifen, etwa, indem nur einzelne Moleküle geblockt würden. Einzelne Medikamente leisten das bereits.
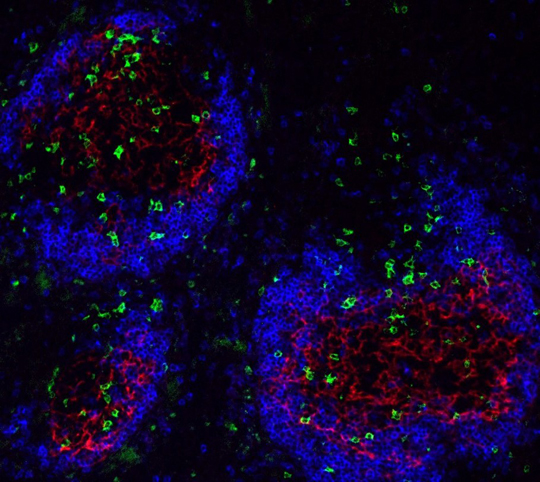 In Grün dargestellt sind spezifische T-Lymphozyten, die in die blau-rot dargestellten Keimzentren einwandern und dort die Produktion von Autoantikörpern unterstützen. Quelle: Nina Chevalier, DOI 10.1002/art.39481
In Grün dargestellt sind spezifische T-Lymphozyten, die in die blau-rot dargestellten Keimzentren einwandern und dort die Produktion von Autoantikörpern unterstützen. Quelle: Nina Chevalier, DOI 10.1002/art.39481
Komponenten einer Kettenreaktion
Auch Chevalier beschäftigt sich im Zuge ihrer Forschung mit Molekülen. „Mich interessiert, was der Umweltfaktor mit den Immunzellen X, Y und Z macht und warum dann eine Krankheit ausgelöst wird.“ Chevalier arbeitet mit Mausmodellen. In einem Mausmodell zur rheumatoiden Arthritis etwa könne die Erkrankung durch das Zusammenbringen zweier Komponenten ausgelöst werden, erklärt sie: einer spezifischen T-Zelle (Abwehrzelle) und eines körpereigenen Antigens (Autoantigens), das von dieser T-Zelle erkannt wird. Treffen beide aufeinander, wird die krank machende Kettenreaktion in Gang gesetzt: Das Autoantigen wird erkannt, was zur Folge hat, dass die T-Zelle stark aktiviert wird und mit anderen Immunzellen, wie zum Beispiel B-Zellen, interagiert. „Das wiederum führt dazu, dass die B-Zellen expandieren, differenzieren und Autoantikörper ausbilden“, erklärt Chevalier. Die Folge ist eine Arthritis.
Verstärker im molekularen Zusammenspiel
Im nächsten Schritt wurden die Mäuse, die durch Zelltransfer beide Komponenten in sich trugen, mit Erkrankungen, die auf infektiöse Erreger zurückzuführen sind, manipuliert – mit einer Darmentzündung zum Beispiel oder mit einer Influenzapneumonie. Und tatsächlich, erzählt Chevalier, sei die Arthritis geboostert, also verstärkt worden. Die Mäusepfoten wurden rot und schwollen stark an. Chevalier gelang es, die Booster zu identifizieren: etwa lösliche Faktoren wie den Botenstoff Interleukin-1-beta, der die Bildung stark entzündungsfördernder TH17-Zellen auslöst. „Bei unseren Influenza- und Kolitis-Mäusen waren diese total hochreguliert.“ Chevalier konnte auch den Nachweis erbringen, dass diese Faktoren in dem molekularen Zusammenspiel wie Verstärker wirken – indem sie die Rezeptoren zur Erkennung dieser Faktoren ausknockte und somit die Signalprozesse im Zellinneren blockierte: Es gab keine Information, somit keine Reaktion und deshalb keine Entzündung.
 Hülsenfrüchte für eine gesunde Ernährung: Ballaststoffe werden im Darm in kurzkettige Fettsäuren zerlegt, die antientzündliche Effekte auch auf Immunzellen haben. Foto: zerbor/stockk.adobe.com
Hülsenfrüchte für eine gesunde Ernährung: Ballaststoffe werden im Darm in kurzkettige Fettsäuren zerlegt, die antientzündliche Effekte auch auf Immunzellen haben. Foto: zerbor/stockk.adobe.com
Vorteil von Ballaststoffen
Dies ist nur ein Aspekt von Chevaliers Arbeit. Bei Mäusen mit Lupus erythematodes untersucht sie darüber hinaus die Wirkung einer ballaststoffreichen Ernährung. „Was an Ballaststoffen aufgenommen wird“, so die Freiburger Wissenschaftlerin, „wird im Darm in kurzkettige Fettsäuren zerlegt“ – und diese haben antientzündliche Effekte, zum Beispiel auf die Immunzellen. Sie verbessern aber auch die Produktion von Schleim, der die Darmwand auskleidet und abdichtet. Und das ist gut, denn durch eine undichte Darmwand können Bakterien in den Blutkreislauf gelangen. Ihre Mäuse setzt Chevalier darum auf Diät. Einige bekommen viel, andere kaum Ballaststoffe. „Da haben wir spannende Ergebnisse. Wir sehen, dass Tiere, die in hohen Dosen Ballaststoffe bekommen, einen deutlich besseren Erkrankungsverlauf zeigen.“ Chevalier und ihr Team konnten außerdem nachweisen, dass das Immunsystem von Mäusen, die ballaststoffreich ernährt wurden, deutlich weniger aktiviert war als das der Vergleichsgruppe. Auch waren die „Ballast-Mäuse“ deutlich schlanker. Auf der anderen Seite synthetisiert weißes Fett viele entzündliche Botenstoffe, die wiederum Immunzellen aktivieren.
Die Mechanismen sind hochkomplex. Immunzellen, Botenstoffe, Entzündungsmediatoren, alles greife ineinander. Chevaliers Forschung sondiert das Zusammenspiel dieser Faktoren und liefert vielversprechende Therapieansätze: ob mithilfe von Medikamenten, mit denen krank machende Prozesse spezifischer blockiert werden können als bisher, oder durch die Umstellung von Ernährungsgewohnheiten. Der Vorteil bei Letzterem: Patientinnen und Patienten können den Therapieerfolg beeinflussen – indem sie weniger Burger essen.
Stephanie Streif

