Waffen der Bakterien
Freiburg, 21.03.2013
Die Bakterien Photorhabdus luminescens leben im Darm von millimetergroßen Würmern, die Insekten befallen und töten. Deshalb werden die Würmer als biologische Insektizide eingesetzt. Sie dringen in Insektenlarven ein, um dort die Photorhabdus-Bakterien auszuspeien. Diese bilden Giftstoffe, die die Insekten töten. Dadurch entsteht ein optimales Nahrungsreservoir, das eine rasche Vermehrung von Würmern und Bakterien ermöglicht. Zu den wirksamsten Giftstoffen von Photorhabdus gehört der Tc-Toxinkomplex, der aus den Komponenten TcA, TcB und TcC besteht. TcA ist für die zelluläre Aufnahme des Toxins zuständig. TcC besitzt die biologische Aktivität, die die Insekten tötet. TcB ist offenbar ein Vermittler von TcA und TcC.
Die Arbeitsgruppe um Prof. Dr. Dr. Klaus Aktories und Dr. Alexander Lang vom Pharmakologischen Institut der Universität Freiburg hat erst kürzlich den zellulären Wirkmechanismus des Toxins aufgeklärt. Jetzt zeigen die Forscher in einer Studie, die in der renommierten Zeitschrift „Nature“ veröffentlicht wurde, in Zusammenarbeit mit den Strukturbiologen der Arbeitsgruppe um Dr. Stefan Raunser und Dr. Christos Gatsogiannis vom Max-Planck-Institut für molekulare Physiologie in Dortmund sowie mit Prof. Dr. Roland Benz, Universität Bremen, den Aufbau und Mechanismus der Toxininjektion in die Zielzellen. Die zentrale Frage war: Wie schaffen es die riesengroßen Eiweißmoleküle des bakteriellen Giftstoffs, durch die Zellmembran zu dringen? Die Strukturbiologen um Raunser haben den Aufbau von TcA in extrem hoher Auflösung dargestellt. Dabei zeigte sich, dass diese bakteriellen Toxininjektionsnadeln aus fünf Einheiten von TcA bestehen. Sie haben eine trichterähnliche Form mit einer Hülle und einem Kanal in der Mitte. Er besteht aus zahlreichen spiralartigen Aminosäuresträngen und ist zunächst durch eine Eiweißhülle an einer Seite verschlossen. An der anderen Seite des Kanals sitzen die Toxinkomponenten TcB und TcC. Wird das Toxin durch Veränderung des Säure-/Basen-Milieus aktiviert, kommt es zu einer dramatischen Umfaltung des Riesenmoleküls. Dadurch wird der untere Teil der Injektionsnadel von seiner Hülle, ähnlich wie bei einer Spritze, befreit, öffnet sich und wird durch die Zellmembran geschoben.
Die Forscher vermuten, dass durch diesen Kanal die TcC in die Zelle transportiert werden. Die Messung der elektrischen Kanaleigenschaften an künstlichen Membranen bestätigt die elektronenmikroskopischen Befunde. Struktur des Injektionsapparats und Mechanismus der Toxininjektion sind einzigartig und unterscheiden sich grundsätzlich von den bisher bekannten Toxinen. Die Aufklärung des neuen Mechanismus ist von grundlegender Bedeutung für das Verständnis von Toxintransport durch Membranen und könnte sogar für den Transport von Medikamenten in kranke Zellen in Frage kommen.
Darstellung: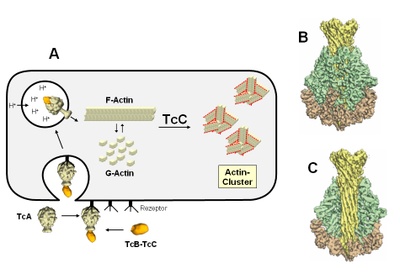
Bildunterschrift:
A: Nach Bindung an einen Rezeptor wird das bakterielle Toxin durch TcA als Injektionsnadel in die Zielzellen „injiziert“. Veränderungen der Struktur von TcA bei der Mikroinjektion sind gezeigt. In der Zelle hemmt das Toxin die normale Regulation des Zellskelettproteins Actin. Es kommt zur Clusterbildung und zum Funktionsverlust von Actin.
B und C: Vergrößerte Darstellung der Struktur des Mikroinjektionsapparates TcA
(modifiziert nach C. Gatsogiannis et al. Nature doi: 10.1038/nature11987)
Originaltitel der Veröffentlichung:
Christos Gatsogiannis, Alexander E. Lang, Dominic Meusch, Vanda Pfaumann, Oliver Hofnagel, Roland Benz, Klaus Aktories und Stefan Raunser lautet „A syringe-like injection mechanism in Photorhabdus luminescens toxins”. Nature. 2013 Mar 28. doi: 10.1038/nature11987.
Kontakt:
Prof. Dr. Dr. Klaus Aktories
Pharmakologisches Institut
Tel.: 0761/203-5301
E-Mail: klaus.aktories@pharmakol.uni-freiburg.de
Die Druckversion der Pressemitteilung (pdf) finden Sie hier.

