Wie sich das Hirn beim Lernen neu verdrahtet
Freiburg, 16.03.2022
Unsere Gehirne verändern ihre materielle Struktur, wenn wir lernen – das ist lange bekannt. Diese Anpassungsfähigkeit, auch Plastizität genannt, verschafft uns enorme Vorteile und ist oft genug überlebenswichtig. Aber was genau passiert dabei im Hirn? Welche neuronalen Mechanismen und Funktionsprinzipien kommen hier zum Tragen? Zwei Forschungsteams um Prof. Dr. Stefan Rotter vom Bernstein Center der Universität Freiburg haben nun eine neue Variante lernender Netzwerke vorgeschlagen und deren Leistungsfähigkeit mit Hilfe von Computersimulation demonstriert. Das neue Modell geht von der vielfach bestätigten experimentellen Beobachtung aus, dass sich Nervenzellen immer wieder neu vernetzen. Laut den Wissenschaftler*innen passiert das ständig – auch in reifen Gehirnen, und in einem viel stärkerem Maße, als die meisten Lehrbücher vermuten lassen. Einige Vorhersagen der auf dieser Basis vorgenommenen Modellrechnungen wurden in eigens durchgeführten Experimenten an biologischen Gehirnen bestätigt.
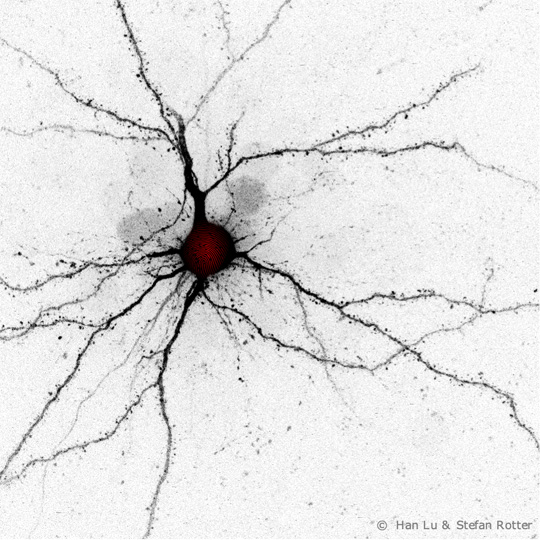 Das Forschungsteam ermittelt durch Experimente eine zeitliche Abfolge von synaptischen Ab- und Aufbauprozessen im Hirn, die es, analog zu einem „Fingerabdruck“, als starkes Indiz für die Richtigkeit ihres neuen Netzwerk-Modells betrachtet. Foto: Han Lu, Stefan Rotter
Das Forschungsteam ermittelt durch Experimente eine zeitliche Abfolge von synaptischen Ab- und Aufbauprozessen im Hirn, die es, analog zu einem „Fingerabdruck“, als starkes Indiz für die Richtigkeit ihres neuen Netzwerk-Modells betrachtet. Foto: Han Lu, Stefan Rotter
Jede Nervenzelle hat sich selbst im Blick
„Entscheidend ist, wie Nervenzellen im Hirn miteinander kommunizieren, wie sie sich mit Hilfe von Synapsen untereinander verbinden und größere Einheiten bilden“, sagt Rotter, Professor für theoretische und computergestützte Neurowissenschaften an der Fakultät für Biologie. Schon 1949 hatte der Psychologe Donald O. Hebb postuliert: „Neuronen verdrahten sich, wenn sie gemeinsam aktiv sind“ („Neurons wire together if they fire together“) – bekannt geworden als Hebbsche Lernregel. Bisher geht man davon aus, dass der Schlüssel für diesen Prozess hauptsächlich in der elektrochemischen Feineinstellung bereits vorhandener Synapsen zu suchen ist. Die Regelung einer Synapse nimmt dabei Bezug auf die Aktivität der beiden beteiligten Nervenzellen. Und das Steuersignal dafür, eine Form von Korrelation, muss separat für jedes einzelne Paar von Nervenzellen berechnet werden.
Gemeinsam mit Dr. Júlia Gallinaro und Nebojša Gašparović hat Rotter nun ein Konzept entwickelt, das deutlich weniger komplex ist und robusteres Lernverhalten zeigt. Der Ausgangspunkt: Jede Nervenzelle hat erst einmal nur sich selbst im Blick – mit dem Ziel, ihr eigenes Aktivitätsniveau aufrecht zu erhalten. Dabei funktioniere sie wie ein Thermostat, bei dem man „Temperatur“ durch „Aktivität“ ersetze, so Rotter: Ist die Aktivität einer Nervenzelle zu hoch, wird die Anzahl der eigenen ein- und ausgehenden, erregenden Synapsen reduziert. Ist ihre Aktivität zu niedrig, werden neue erregende Synapsen angelegt. „Homöostatische Kontrolle“, nennt Rotter diese Selbstregulation.
Neuronen kontaktieren alle, die bereit dazu sind
Der Clou dabei: Die Eliminierung von bestehenden und die Bildung von neuen Kontakten im zellulären Netzwerk erfolgt ansonsten nach dem Zufallsprinzip. Suchen Neuronen nach dem Ende einer Stimulation nach neuen Partnern, um ihr Aktivitätsniveau aufrecht zu erhalten, stoßen sie dabei zwangsläufig auf die Nervenzellen, mit denen sie zuvor gemeinsam stimuliert wurden – und die jetzt ebenfalls auf der Suche nach neuen Kontakten sind. Auf diese Weise geschieht es ganz zwanglos, dass Neuronen, die gemeinsam feuern, sich schließlich auch miteinander verdrahten – und zwar ohne weiteren Bedarf an Regulation.
In Computersimulationen funktioniere dieses Modell sehr gut, sagt Rotter: „Eine Reihe aus der Psychologie bekannter Lernparadigmen, wie etwa klassische Konditionierung oder assoziatives Gedächtnis, lassen sich mit dieser Regel unkompliziert umsetzen.“
Umverdrahtung des Netzwerks
Eine direkte experimentelle Überprüfung dieses auf ständiger Umverdrahtung basierenden Modells ist mit aktueller Technik nicht möglich – dennoch gibt eine zweite Forschungsarbeit deutliche Hinweise auf seine Richtigkeit. Sie wurde von Dr. Han Lu, Júlia Gallinaro und Stefan Rotter gemeinsam mit Prof. Dr. Claus Normann vom Universitätsklinikum Freiburg und Dr. Ipek Yalçın (Centre national de la recherche scientifique und Université de Strasbourg/Frankreich) vorgelegt.
Auch hier entwickelten die Wissenschaftler*innen zunächst eine Computersimulation, die nach einer Stimulation von Nervenzellen eine massive Umverdrahtung zeigt, verbunden mit einer Neuorganisation ihres gesamten „sozialen“ Netzwerks. Anschließend setzten die Forscher*innen im Labor so genannte optogenetische Stimulation in den Hirnen von Mäusen ein. Dabei werden künstlich lichtempfindlich gemachte Nervenzellen wiederholt mit Licht stimuliert. Schließlich verglichen sie die gemessenen Veränderungen im Gehirn der Tiere mit den Ergebnissen aus den Computersimulationen.
Experiment zeigt „Fingerabdruck“ des Modells
Und tatsächlich lassen sich die durchgeführten Messungen so interpretieren, dass die Stimulation der Nervenzellen in den Mäusehirnen zunächst zu einem Abbau von Synapsen führt – vermutlich, weil die Zellen auf das erhöhte Erregungsniveau reagierten – und nach dem Ende der Stimulation dann zum Neuaufbau von Verbindungen der zuvor gemeinsam stimulierten Zellen. Und nicht nur das: „Wir haben dabei genau denselben charakteristischen Zeitverlauf beobachtet, den wir vorher in der Computersimulation gesehen hatten“, sagt Rotter. Die Abfolge von synaptischen Ab- und Aufbauprozessen betrachtet das Team, analog zu einem „Fingerabdruck“, als starkes Indiz für die Richtigkeit seines Modells.
Die Struktur des Netzwerks ändert sich und die Funktion passt sich an, ohne alles bisher Gelernte zu vergessen: Laut Rotter könnte das neue Modell dazu beitragen, diesen faszinierenden Prozess besser zu verstehen. „Ich denke, künftige Forschung sollte die strukturelle Plastizität viel stärker in den Blick nehmen“, sagt er. „Das ist bislang noch sehr wenig geschehen, wohl aufgrund der mit solchen Experimenten verbundenen technischen Schwierigkeiten.“
Originalpublikationen:
Gallinaro, J., Gašparović, N., Rotter, S. (2022): Homeostatic control of synaptic rewiring in recurrent networks induces the formation of stable memory engrams. In: PLOS Computational Biology, 18(2). https://doi.org/10.1371/journal.pcbi.1009836
Lu, H., Gallinaro, J.V., Normann, C., Rotter, S., Yalçın, I. (2021): Time Course of Homeostatic Structural Plasticity in Response to Optogenetic Stimulation in Mouse Anterior Cingulate Cortex. In: Cerebral Cortex, bhab281. https://doi.org/10.1093/cercor/bhab281
Kontakt:
Prof. Dr. Stefan Rotter
Bernstein Center Freiburg
Albert-Ludwigs-Universität Freiburg
Tel.: 0761/203-9316
E-Mail: stefan.rotter@bio.uni-freiburg.de

