Tür und Türsteher zugleich
Freiburg, 28.08.2019
Prof. Dr. Chris Meisinger erforscht im Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg den Proteinkomplex TOM. Dieser wählt aus, welche Proteine in Mitochondrien – die Kraftwerke der Zelle – hinein dürfen. Das wechselt, denn je nach den zellulären Bedingungen verändert sich TOM und trifft eine andere Auswahl. Meisinger interessieren besonders die Signalwege, die für TOMs Änderungen zuständig sind. Sie spielen möglicherweise auch bei der Tumorentstehung eine Rolle.
 Chris Meisinger forscht im Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg und ist zudem Sprecher des frisch bewilligten Sonderforschungsbereichs 1381 „Dynamic organization of cellular protein machineries“. Foto: Jürgen Gocke
Chris Meisinger forscht im Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg und ist zudem Sprecher des frisch bewilligten Sonderforschungsbereichs 1381 „Dynamic organization of cellular protein machineries“. Foto: Jürgen Gocke
In allen Zellen kommen Mitochondrien als Organellen vor. Sie sind durch zwei Membranen vom übrigen Zellplasma abgetrennt. Indem sie Nahrungsbestandteile umwandeln, sorgen sie dafür, dass Zellen genug Energie für ihre Aufgaben bekommen. Dazu müssen viele Proteine aus den Zellen in die Mitochondrien gelangen. Der Transport findet selektiv statt, also nur für Proteine, die eine Funktion in Mitochondrien haben. Ein Proteinkomplex namens TOM in der äußeren Membran regelt daher, welche Proteine in die Mitochondrien hinein dürfen und welche nicht. TOM ist Eintrittstür und Türsteher zugleich.
Früher herrschte in der Forschung die Ansicht vor, TOM lasse jedes Protein jederzeit durch. „Es galt quasi als Dogma, dass er immer offen ist“, sagt Chris Meisinger vom Institut für Biochemie und Molekularbiologie der Universität Freiburg: „Angeblich werde nur die Menge der Proteine reguliert, die die Zelle zu TOM schickt.“ Doch Meisinger zeigte, dass TOMs Aktivität über Phosphorylierungen, kleine biochemische Veränderungen, fein gesteuert ist: Wer an dem Tür-Türsteher-Komplex vorbei will, braucht einen Ausweis und muss zudem zur richtigen Zeit anstehen. Im Exzellenzcluster CIBSS will Meisinger weiter untersuchen, wie Phosphorylierungen TOMs Funktion regulieren. Die biochemischen Änderungen spielen womöglich auch eine Rolle, wenn Tumore entstehen.
Zelluläre Energieproduktion erfordert viel Abstimmung
„Die Fachwelt hat lange gedacht, dass Mitochondrien ziemlich autonom sind“, erzählt Meisinger. In erdgeschichtlicher Vorzeit waren die Organellen wohl eigenständige Organismen, nämlich Bakterien. Heute befinden sie sich als so genannte Kompartimente in den Zellen, von denen sie sich mit zwei Membranen abschotten. Darüber hinaus besitzen Mitochondrien eigenes Erbgut und damit beste Voraussetzungen für Eigenständigkeit. Warum sollten sie also mit dem Rest der Zelle mehr austauschen als ein paar Stoffwechselprodukte wie die Hauptenergieeinheit ATP?
|
Biologische Signale und Signalwege Damit Billionen von Zellen geordnete Gewebe, Organe und gesunde Organismen bilden, erhalten und regenerieren, ist eine sehr genaue Abstimmung nötig. Dazu laufen komplexe Kommunikationsprozesse zwischen und innerhalb von Zellen ab. Defekte in diesen Kommunikationsnetzwerken können Entwicklungsstörungen, Immunschwäche, Krebs und andere Erkrankungen auslösen. Der Cluster CIBSS verfolgt das Ziel, ein umfassendes Verständnis von diesen Kommunikationsprozessen zu gewinnen – von der molekularen Ebene bis hin zur Ebene von Zellen und Organen. Des Weiteren werden CIBSS-Forschungsgruppen untersuchen, wie diese Kommunikationsprozesse mit anderen wichtigen biologischen Prozessen, wie etwa dem Stoffwechsel, in Verbindung stehen. Basierend auf den neuen Erkenntnissen werden die Forschenden Perspektiven entwickeln, um Herausforderungen in der Immuntherapie oder der nachhaltigen Produktion von Nutzpflanzen zu begegnen.
|
|
Nach Jahren intensiver Forschung erkannten Wissenschaftlerinnen und Wissenschaftler jedoch: Mehr als 99 Prozent aller Proteine, aus denen Mitochondrien bestehen, stammen nicht von den Organellen selbst. Sie entstehen außerhalb, im so genannten Cytosol der Zelle. Diese mitochondrialen Proteine besitzen einen Adresszusatz – eine Art Ausweis, den TOM erkennt. Dann, so die lange vorherrschende Meinung, lässt er alle Proteine ein, die den Ausweis haben. „Doch vor etwa zehn Jahren hat sich angedeutet, dass der Proteintransport vom Cytosol in die Mitochondrien koordiniert ist – dass viel Kommunikation zwischen den Zellen und Mitochondrien stattfindet“, sagt Meisinger. Schon allein, wie beide bei der Energieproduktion miteinander kooperieren, musste Abstimmung und Signalwege erfordern. Angetrieben von dieser Hypothese und seinem Bauchgefühl stieg der Biochemiker damals in das Thema ein: „Eine der besten Entscheidungen meiner Karriere.“
Der Tür-Türsteher kontrolliert Protein-Ausweise
Heute erforscht seine siebenköpfige Arbeitsgruppe, wie Phosphorylierungen mitochondriale Proteine beeinflussen. Zellen können viele Enzyme und andere Proteine an- oder abschalten, indem sie Phosphate anhängen oder abspalten. Die Muster dieser Phosphorylierungen ändern sich also. Beim Tür-Türsteher-Komplex TOM bestimmt die Art seines Phosphorylierungsmusters, welcher Ausweis gerade der richtige ist. TOM lässt nur Proteine hinein, die zur richtigen Zeit den passenden Ausweis vorweisen. Alle anderen weist er ab. Unklar ist jedoch, welche Signalwege zur Phosphorylierung des TOM-Komplexes führen „Unter welchen Bedingungen finden diese Phosphorylierungen statt?“, fragt Meisinger. „Und wie geben Mitochondrien eine Rückmeldung an die Zelle?“
So viel weiß der Forscher schon: TOMs Phosphorylierungsmuster ändert sich sehr stark mit dem Nahrungsangebot. „Damit ist garantiert, dass Mitochondrien die Zellen jederzeit optimal mit Energie versorgen können.“ Entsprechend hat auch der Energiebedarf großen Einfluss. Wenn sich Zellen teilen, brauchen sie beispielsweise viel Energie in Form von ATP. Kurz vor der Teilung werden daher viele Proteine, die wichtig zur ATP-Herstellung sind, von TOM in das Mitochondrium gelassen. Zu diesem Mechanismus hat Meisingers Team wegweisende Entdeckungen gemacht.
Diese könnten irgendwann dabei helfen, Tumore zu bekämpfen. Schon im vergangenen Jahrhundert hat der Biochemiker Otto Heinrich Warburg aufgedeckt, dass Tumore Energie oft durch Glykolyse – den Abbau von Einfachzuckern – im Cytosol statt in den Mitochondrien gewinnen. „Tumorzellen schalten häufig von respiratorischer Energiegewinnung auf glykolytische um“, drückt es Meisinger aus. Nach dem Entdecker spricht man vom Warburg-Effekt. Wie Tumore ihn genau nutzen, weiß niemand so recht. Normale Zellen schlagen den glykolytischen oder anaeroben Weg nur ein, wenn ihnen der Sauerstoff ausgeht.
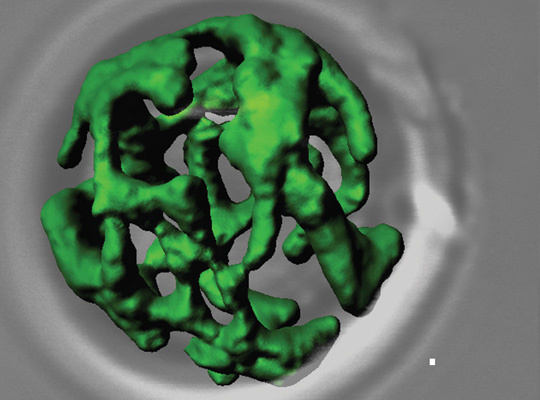 Netzwerkartige Struktur von Mitochondrien (grün gefärbt) aus dem Modellorganismus der Bäckerhefe. Quelle: AG Meisinger
Netzwerkartige Struktur von Mitochondrien (grün gefärbt) aus dem Modellorganismus der Bäckerhefe. Quelle: AG Meisinger
Lässt sich Tumorzellen die Energie abdrehen?
Gerade dieser Unterschied zwischen Tumorzellen und normalen Zellen könnte sich vielleicht als nützlich erweisen: Wenn der Warburg-Effekt anläuft, wechselt nämlich das Phosphorylierungsmuster von TOM. „Er legt den Schalter von respiratorisch auf glykolytisch um“, berichtet der Biochemiker über seine neuesten Ergebnisse. Vielleicht lässt sich diese „Warburg-Phosphorylierung“ hemmen, also der Schalter blockieren – um somit Tumorzellen den Energiehahn abzudrehen? Oder es lassen sich ähnliche Vorgänge regulieren?
In Meisingers Forschung spielt es zurzeit eine übergeordnete Rolle, die zugrunde liegenden Mechanismen zu verstehen. Seine Gruppe macht Grundlagenforschung an Bäckerhefe. Die Ergebnisse, betont er, seien größtenteils auf alle Eukaryonten – Lebewesen mit Zellkern – übertragbar, einschließlich des Menschen: „Für Hefeforschung gab es wohl schon mehr Nobelpreise als für das Arbeiten mit menschlichen Zellen.“ Ihn freut, dass er sich mit den Signalprozessen an Mitochondrien ein spannendes Forschungsgebiet erarbeitet hat: Die Fachwelt kennt inzwischen schon mehrere Hundert Phosphorylierungsstellen an mitochondrialen Proteinen. Nach seinen Zielen in CIBSS gefragt, liebäugelt Meisinger auch mit Anwendungen. Gerne würde er Angriffspunkte finden, um mitochondriale Funktionen manipulieren zu können. „Etwa über das Protein, das TOM so phosphoryliert, dass der Warburg-Effekt bei Tumoren anspringt“, sagt der Forscher.
Wissenschaftlich begann Meisingers Laufbahn mit einem Studium der Chemie und Biochemie an der Universität Freiburg. Dort hat er auch promoviert und sich in Biochemie und Molekularbiologie habilitiert. Obwohl ihn 2008 drei andere deutsche Universitäten haben wollten, hat er sich entschieden, in seiner Geburtsstadt zu bleiben. Das Umfeld in Freiburg sei optimal, findet der Sprecher des frisch bewilligten Sonderforschungsbereichs 1381 „Dynamic organization of cellular protein machineries“. Hier könne er bestens seiner wissenschaftlichen Neugier freien Lauf lassen, sagt Chris Meisinger: „Hierbei wünsche ich mir für die Zukunft noch viele überraschende Forschungsergebnisse.“
Jürgen Schickinger
CIBSS – Centre for Integrative Biological Signalling Studies
CIBSS ist einer der beiden neuen Exzellenzcluster der Universität Freiburg. Darin werden mehr als 60 Arbeitsgruppen biologische Signalprozesse von Immunzellen, rund um Mitochondrien, in der Organentwicklung und in Wurzeln von Pflanzen erforschen. Die Wissenschaftlerinnen und Wissenschaftler kommen aus sechs Fakultäten – der Fakultät für Biologie, Mathematik und Physik, Medizin, Chemie und Pharmazie, Technik sowie der Fakultät für Rechtswissenschaften. Auch das Universitätsklinikum sowie das Max-Planck-Institut für Immunbiologie und Epigenetik sind beteiligt. Die Deutsche Forschungsgemeinschaft fördert den Cluster von Anfang 2019 bis Ende 2025.
CIBSS – Centre for Integrative Biological Signalling Studies